1. Khái niệm về ELISA
Nguyên tắc: Phương pháp ELISA (Enzyme Linked Immunosorbent Assay- xét nghiệm hấp thụ miễn dịch liên kết với enzyme) có rất nhiều dạng mà đặc điểm chung là đều dựa trên sự kết hợp đặc hiệu giữa kháng nguyên và kháng thể, trong đó kháng thể được gắn với một enzyme. Khi cho thêm cơ chất thích hợp (thường là nitrophenol phosphate) vào phản ứng, enzyme sẽ thủy phân cơ chất thành một chất có màu. Sự xuất hiện màu chứng tỏ đã xảy ra phản ứng đặc hiệu giữa kháng thể với kháng nguyên và thông qua cường độ màu mà biết được nồng độ kháng nguyên hay kháng thể cần phát hiện.
Phương pháp này được thiết kế cho việc phát hiện và định lượng vật chất như peptides, protein, antibodies, hormone,… Đôi khi nó còn được gọi bởi một tên gọi khác là EIA (Enzyme ImmunoAssay)
Kĩ thuật này khá nhạy và đơn giản, cho phép ta xác định kháng nguyên hoặc kháng thể ở một nồng độ rất thấp (khoảng 0,1 ng/ml). So với kĩ thuật miễn dịch phóng xạ (RIA- Radio Immuno Assay) thì kĩ thuật này rẻ tiền và an toàn hơn mà vẫn đảm bảo độ chính xác như nhau. ELISA được dùng để xác định nhiều tác nhân gây bệnh như virus, vi khuẩn, nấm, kí sinh.
Kĩ thuật ELISA gồm ba thành phần tham gia phản ứng là: kháng nguyên, kháng thể và chất tạo màu; thực hiện qua hai bước:
- Phản ứng miễn dịch học: Là sự kết hợp giữa kháng nguyên và kháng thể
- Phản ứng hóa học: Thông qua hoạt tính xúc tác của enzyme làm giải phóng oxy nguyên tử [O] từ H2O2 để oxy hóa cơ chất chỉ thị màu, do đó làm thay đổi màu của hỗn hợp trong dung dịch thí nghiệm.
(Trích từ Chemicon International)
2. Phân loại ELISA
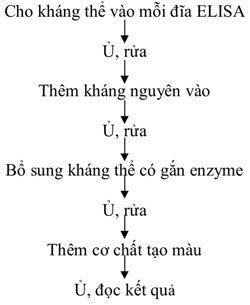
2.1. Direct ELISA (ELISA trực tiếp) Direct ELISA: Đây là dạng đơn giản nhất của phương pháp ELISA. Trong đó, kháng nguyên cần phát hiện sẽ được gắn trực tiếp lên bề mặt giá thể và sẽ được phát hiện bằng một kháng thể duy nhất (kháng thể này đã được gắn enzyme).

Sơ đồ 2.1: Tiến trình thực hiện phản ứng ELISA trực tiếp
- Ưu điểm: Đơn giản nhất
- Nhược điểm:
+ Độ đặc hiệu bị giới hạn vì thường thì kháng nguyên có ít nhất là 2 epitope (trình diện kháng nguyên) mà phương pháp này chỉ sử dụng 1 kháng thể gắn vào một epitope.
+ Phải đánh dấu cho từng kháng thể chuyên biệt với từng đối tượng.
2.2. ELISA gián tiếp Indirect ELISA: Phương pháp này khác Direct ELISA ở chỗ kháng thể bắt kháng nguyên không được gắn enzyme mà nó là mục tiêu gắn đặc hiệu của một kháng thể khác (kháng thể này mới là kháng thể được gắn với enzyme).
 Sơ đồ 2.2: Tiến trình thực hiện phản ứng ELISA gián tiếp
Sơ đồ 2.2: Tiến trình thực hiện phản ứng ELISA gián tiếp
- Ưu điểm: Kháng thể gắn enzyme có thể sử dụng để đánh dấu cho nhiều loại kháng nguyên nên tiện lợi và kinh tế hơn, dễ dàng thương mại hóa.
- Nhược điểm: Độ đặc hiệu của từng kháng huyết thanh là khác nhau. Điều này dẫn đến kết quả khác nhau giữa các thí nghiệm và do đó cần phải thử nghiệm với nhiều kháng huyết thanh khác nhau để kết quả có thể tin tưởng được.2.3. Sandwich ELISA
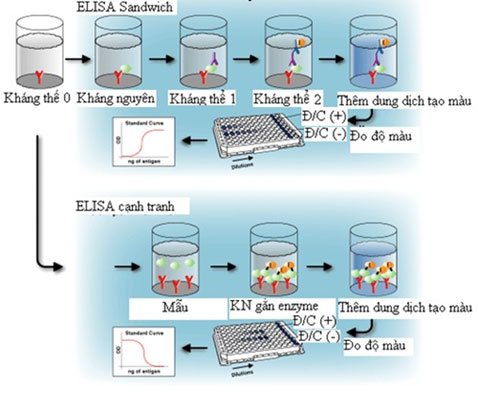
Đây là một dạng ELISA được sử dụng phổ biến nhất trong thực tiễn do nó cho phản ứng mạnh và nhạy. Được gọi là “sandwich” là do kết quả thí nghiệm được đánh giá thông qua sự kết hợp của hai loại kháng thể là kháng thể bắt (capture antibodies) và kháng thể phát hiện (detection antibodies). Kỹ thuật này cũng được phân làm hai dạng là Direct sandwich ELISA (DAS-ELISA - Double antibody sandwich) và Indirect sandwich ELISA (TAS-ELISA – Triple antibody sandwich).
DAS ELISA gồm sự dính thụ động của kháng thể vào pha rắn (đáy giếng). Những kháng thể này sau đó kết hợp với các kháng nguyên được thêm vào. Những kháng nguyên được pha loãng trong blocking buffer nhằm ngăn sự dính không chuyên biệt của chúng vào pha rắn. Ở đây, những phần của blocking buffer không nên chứa bất kỳ kháng nguyên nào mà có thể kết hợp với kháng thể bắt. Sau khi ủ và rửa, chỉ còn phức hợp kháng nguyên - kháng thể dính vào pha rắn.
Kháng thể bắt sau đó được thêm vào. Do vậy, đây là sự kết hợp trực tiếp với kháng nguyên đích và kháng thể bắt. Kháng thể thứ hai này có thể giống kháng thể một hoặc khác về nguồn động vật hay loài động vật sản xuất kháng thể. Sau khi ủ, rửa, thêm cơ chất vào và đọc trên máy đo quang phổ. Vì sử dụng một kháng thể gắn kết với enzyme nên hệ thống bị giới hạn về tính chuyên biệt và những thành phần gắn liền với kháng thể chuyên biệt. Điều này giới hạn sự linh hoạt của phương pháp, ví dụ như mỗi kháng thể được sử dụng phải được đánh dấu riêng (cho những kháng nguyên khác nhau). Theo cách này, direct ELISA bị giới hạn về sự chuẩn bị kháng thể. Hệ thống cũng bị giới hạn ở chỗ kháng nguyên phải có ít nhất hai epitope vì cả hai kháng thể bắt và phát hiện đều kết hợp trực tiếp với kháng nguyên.
Kháng thể bắt trên pha rắn và kháng thể phát hiện có thể chống lại những epitope khác nhau trên phức hợp kháng nguyên. Do đó, thuận lợi khi khảo sát sự khác biệt nhỏ giữa những kháng nguyên nếu sử dụng kháng thể phát hiện và kháng thể bắt khác nhau. Việc sử dụng cùng một kháng thể bắt và phát hiện có thể dẫn đến vấn đề khi có giới hạn về vị trí gắn kết sẵn có cho sự phát hiện. Kích thước và mối quan hệ không gian của các epitope trên kháng nguyên đích là rất quan trọng và có thể ảnh hưởng mạnh đến thử nghiệm.
Sandwich ELISA có thể được chia làm hai hệ thống:
2.3.1 Sandwich ELISA trực tiếp
 Sơ đồ 2.3: Tiến trình thực hiện ELISA Sandwich trực tiếp
Sơ đồ 2.3: Tiến trình thực hiện ELISA Sandwich trực tiếp
- Vì phương pháp này có ưu điểm hơn hẳn những phương pháp khác mà chúng tôi chọn phương pháp này để chẩn đoán bệnh virus đang nghiên cứu.
Chú ý: nếu sử dụng kháng thể bắt và kháng thể phát hiện giống nhau có thể dẫn đến vấn đề nếu có sự giới hạn vị trí kết hợp sẵn có để phát hiện. Mối quan hệ về kích thước và vị trí không gian của các epitope cũng có ảnh hưởng đến thử nghiệm.
2.3.2 Sandwich ELISA gián tiếp
 Sơ đồ 2.4: Tiến trình thực hiện phản ứng ELISA Sandwich gián tiếp
Sơ đồ 2.4: Tiến trình thực hiện phản ứng ELISA Sandwich gián tiếp
2.4. Phản ứng ức chế /cạnh tranh
Phản ứng cạnh tranh mang nghĩa là hai chất tham gia phản ứng cùng ái lực bắt cặp với chất thứ ba. Phản ứng cạnh tranh đúng đắn thì hai chất cạnh tranh phải được đưa vào đồng thời.
Sự khác biệt giữa ức chế và cạnh tranh. Cả hai phản ứng đều có sự tham gia của hai kháng thể phản ứng với kháng nguyên. Nếu một kháng thể được ủ trước phản ứng đó được gọi là ức chế (blocking/ inhibition assays). Phản ứng cạnh tranh mang nghĩa cả hai kháng thể được thêm vàođồng thời với nhau (hình 1).
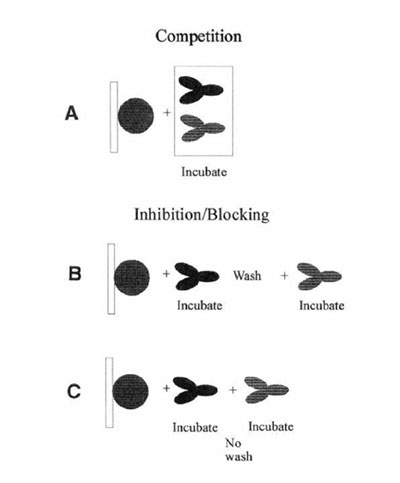
Hình 1 : sự khác biệt giữa ức chế và cạnh tranh
Direct C-ELISA kiểm tra kháng nguyên được mô tả ở sơ đồ 2.5
Trong hệ thống trực tiếp, lượng kháng nguyên trên bề mặt đĩa và lượng kháng thể gắn enzyme đã được chuẩn độ để tối ưu. Kháng nguyên và kháng thể gắn enzyme được thêm vào đĩa cùng một lúc để tạo ưu thế cạnh tranh.
Nếu kháng nguyên tương tự hoặc cùng như kháng nguyên đã được gắn trên đĩa thì kháng thể gắn enzyme sẽ gắn lên kháng nguyên này. Khi nồng độ của kháng nguyên cạnh tranh cao sẽ ngăn cản bất kỳ sự kết hợp của kháng thể gắn enzyme với kháng nguyên trên bề mặt đĩa (cạnh tranh 100%). Nếu nồng độ kháng nguyên cạnh tranh giảm (ví dụ : pha loãng) sự cạnh tranh sẽ giảm. Như vậy nồng độ kháng nguyên cạnh tranh càng cao thì độ hấp thu màu càng giảm.
Kháng nguyên cạnh tranh có thể được thêm trực tiếp vào đĩa nếu nó được pha loãng trong blocking buffer trước khi thêm kháng thể gắn enzyme.
Mức độ cạnh tranh theo thời gian phụ thuộc vào mối tương quan của nồng độ phân tử cần kiểm tra và kháng nguyên trên bề mặt đĩa (và mức độ tương đồng của kháng nguyên).
Sau khi ủ và rửa, lượng kháng thể được đánh dấu được định lượng sau khi thêm cơ chất. khi không có kháng nguyên trong mẫu kiểm tra hay không có sự tương đồng của kháng nguyên thì không có sự gắn kết với kháng nguyên được đánh dấu và không có sự cạnh tranh với kháng nguyên này. Kết quả là mẫu có chứa kháng nguyên thì sự cạnh tranh làm giảm cường độ màu còn đối chứng âm thì không.
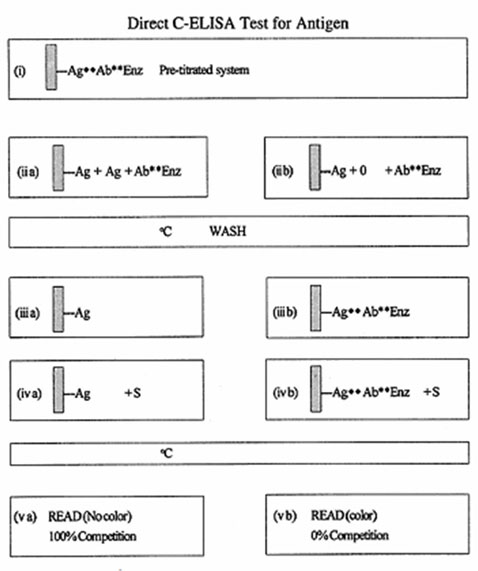
Sơ đồ 2.5. Direct C-ELISA kiểm tra kháng nguyên
2.4.2. Direct C-Elisa: Kiểm tra kháng thể
Direct C-ELISA kiểm tra kháng thể được mô tả chi tiết ở sơ đồ 2.6.
Direct C-ELISA kiểm tra kháng thể tương tự với Direct C-ELISA kiểm tra kháng thể. Sự cạnh tranh ở đây là giữa kháng thể trong mẫu và kháng thể được đánh dẫu với các vị trí trên kháng nguyên trên đĩa. Mẫu và kháng thể đánh dấu được trộn với nhau trước khi thêm vào đĩa.
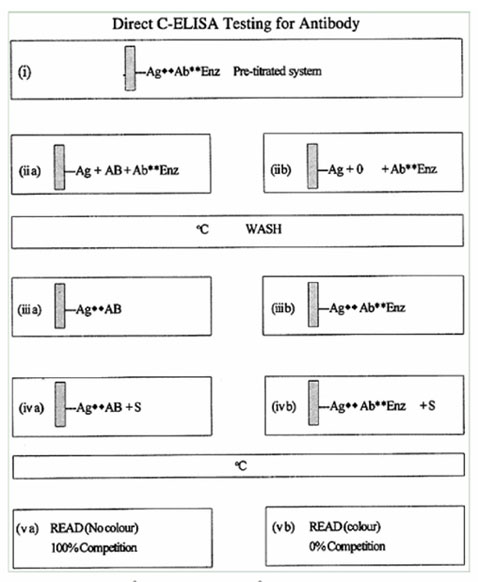
Sơ đồ 2.6. Direct C-ELISA kiểm tra kháng thể
3. Các yếu tố ảnh hưởng đến độ nhạy của phản ứng ELISA - Số lượng kháng thể thứ nhất được gắn vào đáy giếng
- Ái lực của kháng thể thứ nhất đối với kháng nguyên
- Ái lực của kháng thể thứ hai đối với kháng nguyên
4. Các yếu tố ảnh hưởng đến kết quả ELISA
- Nếu các đối chứng âm cho kết quả dương tính thì có thể do sự nhiễm từ chất tạo màu hoặc từ kháng thể được đánh dấu hoặc chính các đối chứng bị nhiễm.
- Nếu màu không xuất hiện đối với đối chứng dương hoặc đối với mẫu thì phải kiểm tra lại tất cả hoá chất bao gồm: hạn sử dụng, nồng độ, điều kiện bảo quản
- Nếu màu xuất hiện quá thấp đối với đối chứng dương và cả mẫu kiểm tra thì phải kiểm tra lại kháng thể được gắn enzyme và nồng độ của chất tạo màu.
- Nếu có tạo màu đối với mẫu nhưng không tạo màu với đối chứng dương thì có thể kiểm tra lại nguồn gốc đối chứng, hạn sử dụng và điều kiện bảo quản.
- Khi chạy lại một thử nghiệm trong điều kiện đang gặp sự cố thì chỉ nên thay đổi một yếu tố thí nghiệm.

Sơ đồ 2.1: Tiến trình thực hiện phản ứng ELISA trực tiếp
Sơ đồ 2.2: Tiến trình thực hiện phản ứng ELISA gián tiếp












